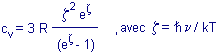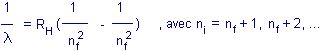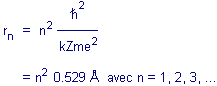La physique quantique
Comprendre la relativité et Histoire
de la physique Quantique
Avant propos:
Qu'est ce que la théorie des Quanta?
Je pense qu'à l'heure actuelle, c'est la théorie humaine la
plus aboutie.
En effet, celle-ci arrive à tout expliquer:
La table périodique des éléments, les réactions chimiques, le
comportement des lasers, les puces électroniques, la stabilité de l'ADN, comment
les particules Alpha quittent le noyau par effet tunnel....
Einstein en dira que c'est une théorie "absconse" et est contraire
au bon sens.
Pauli comparera cette science aux philosophies orientales et
paranormales.
Schrödinger en dira que cette théorie se vérifie toujours.
Pour Planck, c'est une théorie purement mathématique.
Pour Born cette théorie bouleverse la vision du monde.
Avant le XXème siècle beaucoup d'idées sur la physique étaient
difficiles à combattre car par le formalisme elle se vérifiait toujours:
Les lois de la gravitation étaient impeccablement correctes
(Newton 1642 - 1727) ainsi que celles de J C Maxwell sur l'électromagnétisme (1831 - 1897), l'âge de
raison devenait l'âge de la certitude!
Aujourd'hui tout parait sûr pour notre monde macroscopique et
pourtant!
Toutes nos incertitudes de notre monde ont des réponses dans
notre infiniment petit que sont les lois statistiques de la physique quantique
qui bouleversent tous nos concepts rationnels!
Bref, les marmottes risquent de ne plus savoir où elles
campent!
I. Einstein et la notion de relativité :
La découverte la plus
bouleversante que fit Einstein fut sans doute la Théorie de la Relativité. Plus
qu’une simple découverte, il propose une nouvelle manière de penser, de
concevoir l’Univers. Ses recherches furent résolument tournées vers la
relativité des événements, des mesures selon les référentiels. Il prouva que les
notions d’espace et de temps étaient des notions relatives et que l’on ne
pouvait les évoquer sans préciser la référence de mesure. Par exemple la vitesse
de déplacement de la Terre est différente si on la mesure par rapport au soleil
ou par rapport au centre de la galaxie.
Toutefois, une seule mesure et
indépendante de tout référentiel : la vitesse de la lumière dans le vide. Aussi,
de nombreux bouleversements naissent de cette constante. Car si cette vitesse
reste constante quelque soit la vitesse où l’on se déplace pour la mesurer,
c’est bien l’espace et le temps eux-mêmes qui sont variables selon le
référentiel. Le temps et l’espace sont donc bien des notions relatives. Plus
tard Einstein généralise la relativité à l’ensemble des référentiels possibles,
ajoutant donc les mouvements accélérés, achevant ainsi la grande théorie. La
matière apparaît alors comme partie intégrante du tout Espace-temps Matière.
En effet, plus un objet a une
masse importante, plus la force nécessaire pour maintenir une accélération
donnée est importante. De même que précédemment, quelques soient les conditions
dans lesquels s’effectuent les mesures, la lumière a toujours les mêmes
propriétés. C’est alors la masse elle-même qui est modifiée par l’accélération.
Derrière ces concepts assez complexes et abstraits, notre monde est complètement
bouleversé. La géométrie de l’espace et l’écoulement du temps sont modifiés par
la matière.
1.Pourquoi
la « relativité » s’appelle ainsi ?
L’article d’Einstein de 1905 sur
l’électrodynamique des corps en mouvement fonde la relativité sur deux
postulats: que les lois de la physique soient identiques dans tous les systèmes
de référence en mouvement relatif uniforme les uns par rapport aux
autres ( référentiels d’inertie) et que la vitesse de la lumière soit identique
dans tous ces référentiels. Ce principe de relativité, selon lequel les lois
physiques sont indifférentes au référentiel dans lequel on les exprime, est
encore restreint aux mouvements uniformes ( d’ou le nom de relativité
restreinte). Mais il est généralisé par Einstein en 1915 à tous les
référentiels, et plus seulement ceux en mouvement relatif uniforme : la
relativité devient générale.
Le principe de la relativité
signifie en particulier qu’il n’existe aucun référentiel privilégié pour décrire
ces lois, et en particulier que les notions d’espace et de temps absolus de
Newton sont vides de sens. Même si certains peuvent se révéler d’un usage plus
pratique que d’autres, tous les référentiels sont aussi valables que les autres.
Cela n’ouvre nullement la voie à
un quelconque « relativisme philosophique » du genre « il n’y a pas de vérité
absolue, tout se vaut… ». Bien au contraire, utiliser la relativité ( restreinte
ou générale ) signifie rechercher des lois qui restent identiques dans tous les
référentiels…
Concrètement on écrit les
équations de façon covariante ( de sorte que leur forme reste inchangée
dans un changement de référentiel ) et on recherche les invariants, les
quantités qui ne sont pas modifiées dans un changement de référentiel ( par
exemple, l’énergie et l’impulsion d ‘une particule sont modifiées de façon très
précise dans un changement de référentiel et sa masse reste identique ).
2.Les
trois théories successives de la gravitation :
a.
La théorie de la gravitation, ( Newton, 1687) :
Ce qu’il faut savoir de la force de gravitation :
·
La gravitation est une force qui attire deux masses l’une vers
l’autre. Ainsi une pomme tombant d’un arbre est attirée par la Terre, et la
Terre tournant autour du Soleil est attirée par l’astre.
·
La force de gravitation est instantanée. Elle est proportionnelle
au produit des deux masses, et inversement proportionnelle au carré de leur
distance.
·
L’espace préexiste à la matière.
La masse d’un corps est un
facteur qui s’oppose, qui « freine » l’accélération de ce corps par une force
donnée. Donc plus la masse est importante, plus l’accélération sera faible pour
une force donnée :
Ainsi la masse mesure l’inertie
d’un corps, c’est à dire la résistance qu’il oppose à l’accélération
communiquée. Par exemple, un objet en chute libre sur la Terre se voit appliquer
sans cesse d’une force constante : son poids. Si l’on néglige les forces de
frottements dues à l’atmosphère, et d’après Newton, on pourrait constater que
cet objet ne cessera d’accélérer. Or ceci s’oppose à la théorie d’Einstein qui
interdit le dépassement de la vitesse auxquels cas la matière subirait quelques
transformations inhabituelles. En fait cette contradiction est la cause du
mélange entre les théories de la mécanique classique avec la théorie
relativiste. En effet , la masse d’un corps s’approchant de la vitesse de la
lumière devient colossale , puis infinie lorsque cette vitesse est atteinte :
(v² / c²) est toujours inférieur à 1 donc v<c car la racine ne peut être
négative .
Ceci étant impossible , le
dépassement de la vitesse absolue l’est aussi . Soit :
avec mO est la masse de l’objet au repos , v sa
vitesse de déplacement par rapport à nous est m sa masse relative. Mais cette
augmentation ne dépend pas de la masse initiale au repos mais de la vitesse du
corps par rapport à la vitesse de la lumière : 100 kg / (1-(299999²/300000²)^½
=38 730 kg soit une augmentation de plus de 386 fois la masse au repos ! Donc
quand la vitesse du corps tend vers la vitesse de la lumière, sa masse tend vers
l’infini.
De cette conclusion surgit un
remodelage complet de la mécanique classique ; toutes les formes d’énergie
cinétique, potentielle, rayonnement, pression ou même la rotation des astres sur
eux même qui peut froisser localement l’espace deviennent des facteurs
relatifs(toujours par rapport à la constante c) ; par exemple, l’énergie
cinétique s’obtient en faisant la différence de l’énergie d’un corps à la
vitesse v par son énergie au repos ( théoriquement nulle dans un référentiel
donné ). Mais si les vitesses sont faibles par rapport à c, on retrouve la
définition classique de l’énergie cinétique E = ½ m*v², car l’augmentation de
la masse est négligeable.
b. La
relativité restreinte, (Einstein et Poincaré, 1905) :
La vitesse de la lumière dans le
vide est égale à 300 000 Km/s, et cette limite est infranchissable. Matière et
énergie sont équivalentes selon la célèbre formule :
où E est l’énergie, m la masse,
et c la vitesse de la lumière dans le vide. Espace et temps sont intimement
liés : l’Univers a donc quatre dimensions (les trois dimensions de l’espace plus
celle du temps). Elles constituent l’espace-temps.
c.La relativité
générale, (Einstein, 1916) :
Toute masse courbe l’espace
autour d’elle. Les objets se déplacent dans cet espace courbe, et « tombent »
les uns vers les autres. Cette modification de l’espace-temps par la matière se
déplace à la vitesse de la lumière. L’espace n’existe pas de façon absolue.
Chaque corps le modifie et crée de ce fait sa propre géométrie. L’espace est la
somme de toutes ces géométries.
3.
L’univers suivant la théorie de la
relativité générale :
a.
Une équation pour une théorie :
L’équation de la relativité générale s’écrit :
|
Ŕ²/R² - k/R² = ( 8πGρ)/ 3 + λ/ 3 |
Avec : G : constante de gravitation
R : facteur d’échelle(distance entre 2
galaxies)
ρ : densité de matière
λ : constante cosmologique
‘k’ donne le signe de la courbure
De plus on peut regrouper :
·
Ŕ²/R² - k/R² : courbure de
l’Univers
·
( 8πGρ)/ 3 : matière
·
λ/ 3 : énergie du vide
A partir de cette équation on
peut faire des supposition quant à l’avenir de l’Univers.
Les différents scénarios possibles sur le destin de
l’Univers sont :
Ø
sans constante cosmologique : λ=0
·
k=1, l’Univers se contracte et s’effondre sur lui-même. Il se
produit alors un big crunch, phénomène inverse du big bang.
·
k=0, l’Univers est plat, son expansion ralentit indéfiniment sans
jamais s’arrêter.
·
k= -1, l’Univers est ouvert, il continue son expansion à l’infini
Ø
avec constante cosmologique : λ≠0
·
L’expansion de l’Univers serait exponentielle.
b.Effets de la
gravité sur l’Espace-temps :
(8Πk*c¼)*Tμν = Rμν - ½ GμνR
: => L’équation d’Einstein :
Cette équation, au centre de la théorie de la relativité
générale, décrit la gravitation comme une déformation de l’espace temps. La
masse ou l’énergie ( terme de gauche) équivaut à une courbure de l’espace temps
( terme de droite).
Avec : Tμν =
tenseur d’énergie impulsion
Rμν - ½ GμνR
= tenseur d’Einstein
c.Théorie de
l’expansion et loi de Hubble : (cf. : voir 3.1/ )
Prenons de nouveau un phénomène
prédit par la théorie, phénomène étroitement lié au précédent. Notre Univers
peut suivre trois évolutions suivant la masse de matière qu’il contient : si
cette dernière dépasse une valeur critique, l’Univers s’effondrera petit à petit
sur lui-même jusqu’à produire un ‘Big crunch’. Si la masse est égale à cette
valeur, l’Univers est stable. Si elle est inférieure, alors il est en expansion.
Actuellement, et si l’on en croit les calculs des cosmologistes sur la masse
totale de l’Univers, il se produit le phénomène d’expansion. L’Univers n’aurait
donc pas de frontière. Mais il y a toutefois une limite à l’Univers observable.
La loi de Hubble permet en effet de calculer que, à une distance de 15 à 20
milliards d’années-lumière (distance parcourue par la lumière en un an), soit
l’âge de l’univers connu : 15 à 20 G années, les galaxies s’éloignent aussi vite
de nous que leur lumière voyage vers nous. Celle-ci ne peut donc plus nous
atteindre.
|
La physique
quantique
Introduction (I)
A
l'heure actuelle, la "théorie-cadre" de la physique est la mécanique
quantique relativiste. Bien que liée à l'évolution générale de la
physique depuis Newton à Einstein, deux raisons me poussent prudemment à
faire une scission entre l'aspect quantique de la physique et sa
contrepartie relativiste.. Ces
deux aspects de la "théorie-cadre" ont des implications communes, mais
chaque théorie est suffisamment complexe et adulte pour justifier une
étude séparée pour en avoir une bonne compréhension. |
|
La
seconde raison est qu'il n'existe pas encore de théorie quantique relativiste au
sens strict. La relativité restreinte a récemment été quantifiée, mais aucun
mathématicien ni physicien ne peut encore poser les bonnes équations
qu'imposent sa généralisation. Einstein s'en était occupé de 1916 jusqu'en 1955,
l'année où il s'est éteint. Deux générations se sont écoulées depuis sans que
les physiciens parviennent à établir les bonnes équations tellement la théorie
est difficile à formuler.
Le
terme "mécanique" n'est plus du tout approprié à "la quantique" qui englobe
aujourd'hui tous les domaines de la physique et dont les ramifications
s'étendent jusqu’en astrophysique, en biochimie, jusqu'à inclure l'Homme. Malgré
cette évolution le substantif "mécanique" a gardé voix de citer et est assimilé
à celui de "physique" quantique. Aussi, par tradition certains auteurs le
conserve comme titre de chapitre ou l’utilise indifféremment ci et là selon leur
humeur.
Pour
juger objectivement les phénomènes qui obéissent aux lois de la physique
quantique, un résumé de son histoire soulignera le cheminement intellectuel qui
entraîna son introduction dans la physique classique et qui finira par la
remplacer dans le domaine de l'atome. Arrivé à ce point, complété par les
notions de relativité, la distinction entre la physique de Newton, celle
d'Einstein ou de Heisenberg ne fera plus de doute.
Pour
clarifier les notions de physique quantique dont se nourrit dame Nature,
quelques phénomènes en violation avec la réalité viendront conclure cette
introduction, permettant à chacun d'adapter son mode de pensée à ces concepts
tout à fait déconcertants. Les exemples sont éloquents : la dualité de la
lumière, le principe d'indétermination, le paradoxe EPR, les superfluides. Tous
ces exemples appliquent des lois en contradiction avec la physique de Newton et
sont en relation avec l'astronomie et la chimie. Certains physiciens considèrent
que ces phénomènes ont une réversibilité non pas de fait, mais bien de droit.
C'est ici que naissent les paradoxes car ce langage est celui de la physique
classique. Or il est impossible de traiter la physique quantique comme une autre
science car les explications butent encore trop souvent sur notre interprétation
de la “réalité”. Nous insisterons longuement sur ce thème. Le physicien fait
alors appel à la philosophie pour tenter de comprendre un monde phénoménologique
qui lui échappe. Dans ce sens le monde que décrit la physique quantique nous est
voilé. Mais gardons-nous de le considérer comme le seul domaine paradoxal de la
nature.
Les
prémices
|
Devant les prodigieuses avancées des sciences et des techniques au cours du
XIXe
siècle, le chimiste français Marcellin Berthelot s’était
exclamé : “il n’y a pas un problème que la science ne puisse résoudre”.
Lord Kelvin (William Thomson) avait ressentit la même impression et
considéra vers 1852 que : “la physique avait fourni une description
cohérente et a priori complète de l’univers”. Malheureusement ces
certitudes étaient basées sur une vision bien naïve du monde, un monde
considéré comme stable et éternel. La Science ne se souciait guère des
aspects négatifs des découvertes, elle ne posait pas de questions sur son
origine, ses retombées, son éthique. Que devenait dans ce monde simple et
sans mystère, les paradoxes, la conscience, la dimension transcendante du
monde, le non-sens ?
|
 |
|
Lord Kelvin. |
La
philosophie des sciences
Comment
avons-nous appris que la théorie classique ne s’appliquait pas à toute la
réalité ? La physique quantique apparut suite aux difficultés que rencontrèrent
les chimistes et les physiciens du siècle dernier pour expliquer certains
phénomènes naturels. Les théories concernant les différents états de la matière,
la chaleur spécifique ou la réaction des métaux photosensibles ne suivaient pas
les courbes standards. Si les savants avaient bien trouvé des formules pour
prédire ces événements, certains corps s'écartaient obstinément des valeurs
moyennes pour des raisons qui restèrent longtemps mystérieuses. C'est la
thermodynamique qui donna le coup d'envol de la résolution de ces problèmes.
Mais elle-même enchâssée dans le carcan de la philosophie séculaire et
contrainte par la physique classique eut de grosses difficultés pour évaluer la
portée de la nouvelle mécanique quantique.
|
Les acteurs (I) |
 |
 |
 |
|
Amedeo Avogadro, Joseph Louis Gay-Lussac
et Robert Boyle. |
|
Jusqu'au XXe
siècle, la matière n'intéressait pas les physiciens. Cette
science était réservée aux chimistes parmi lesquels nous retrouvons les célèbres
Avogadro, Gay-Lussac, Boyle et tant d'autres. L'Encyclopedia Britannica
publiée en 1771 considérait que les atomes étaient les plus petits corps
naturels indivisibles.. Or depuis Démocrite
on avait déjà remarqué que certains atomes ou plutôt certaines molécules étaient
structurées et présentaient des formes variées et qu'aucunes d'elles ne
pouvaient se transformer en une autre. L'or et le plomb pouvaient bien
s'amalgamer mais il était toujours possible de les séparer par l'action de la
chaleur. Cette définition était donc incomplète et suscita l'intérêt des
chercheurs.
Vers
1774 Antoine Laurent de Lavoisier découvre que les corps composés tels que l'air
ou les minéraux sont constitués d'éléments simples, mélangés dans des
proportions bien déterminées. Lavoisier découvrit 23 éléments chimiques simples.
Il est à juste titre considéré comme l’un des créateurs de la chimie moderne. Il
faudra attendre une génération pour que John Dalton propose le concept atomique en 1803 : il considère que la matière est constituée
de molécules qui sont elles-mêmes composées d'atomes indivisibles. Vers 1860,
August Kekulé von Stradonitz et Butlerow démontrent grâce à la lumière polarisée
que les molécules des gaz obéissent à un comportement structurel particulier, ce
qui leur permettra d'échafauder les principes de l'architecture chimique. C'est
également Kekulé qui précisa le sens des termes d'atomes et de molécules dans
leur définition moderne.
Neuf
ans plus tard Dimitri Mendéléev
proposa une classification des éléments selon leur masse atomique mais il ne put
expliquer les relations entre classes d'éléments. Il faudra attendre quelques
générations pour découvrir les propriétés électriques des atomes et leur
architecture. En 1874 Jacobus van 't Hoff et indépendamment de lui Joseph Le Bel
découvraient que la stéréochimie expliquait les isomères des molécules
organiques.
En 1887
Joseph J.Thomson démontra que le courant électrique qui pouvait se propager dans
un gaz était associé à des particules chargées négativement. En soumettant
celles-ci à un champ magnétique et en observant les déviations des particules,
il pouvait connaître leur charge et leur masse avec précision.
La fin
du siècle fut marquée la découverte des rayons X (Roentgen, 1895) ainsi que de
la radioactivité naturelle (Becquerel, 1896). En 1903, les physiciens anglais
Ernest Rutherford et Frederick Soddy
découvrirent que la radioactivité naturelle était une transmutation d'un atome
dans un autre. Ainsi, les atomes radioactifs pouvaient émettre des particules
positives (rayonnement
a,
un atome d'hélium deux fois ionisé), négatives (rayonnement
b,
des électrons) ou des ondes de très courtes longueurs d'ondes (rayons
g).
Mais il restait à localiser les composantes du rayonnement á et en corollaire
celles du noyau. Quatre ans plus tard, J.J.Thomson
proposa un modèle atomique dans lequel les charges négatives - les électrons -
étaient distribués dans une matrice chargée positivement. Pour respecter la
neutralité de la matière, les électrons devaient avoir exactement les mêmes
valeurs que les charges positives.
Entre-temps
les chimistes et les physiciens ont essayé d'évaluer la dimension des molécules
et de déterminer la nature des forces qui les maintenaient ensembles. Mis à part
les auteurs précités, les travaux les plus concrets et qui témoignent d'une
ébauche de solution sont ceux de R.Brown sur le mouvement brownien datant de
1828 et de R.Clausius en 1857 qui fit la distinction entre les différents états
solides, liquides et gazeux
en fonction de l'agitation moléculaire. Ces travaux seront souvent discutés et
critiqués en termes d'entropie et de leur cohérence vis-à-vis des lois
classiques. Il était évident aux yeux de Planck, Boltzmann ou Sommerfeld que les
phénomènes naturels et en particulier la loi d'entropie ne pouvait être réduite
à des phénomènes purement mécaniques. Ces recherches se termineront avec la
célèbre thèse de doctorat d'Einstein en 1906.
|
Equation d'Einstein du mouvement brownien
|
|
|
|
<x2>
la valeur quadratique moyenne du déplacement par rapport à l'origine
|
|
R, la
constante des gaz
a, le
rayon des molécules-sphères
T, la
température |
h
, la viscosité
N, le
nombre d'Avogadro,
t , le
temps écoulé depuis l'instant 0. |
|
Ainsi
pour de l'eau à 17°C et t=1 min, a = 0.001mm et
√<x2> = 6 µm.
|
|
On savait alors que le rayon de l'atome d'hydrogène oscillait
entre 1 et 2x10-8
cm et l'on estima le nombre d'Avogadro N à environ 6.02 x 1023
molécules par mole. Peu de temps après la publication de cette formule, Einstein
établit une correspondance entre le mouvement brownien isolé et la diffusion
d'un ensemble de particules. Einstein voulait ignorer les détails des phénomènes
de collisions et traita la diffusion comme un processus de Markov
.
Sa
théorie sera appliquée avec succès dans tous les domaines exploitant les
propriétés d'élasticité, de viscosité et d'écoulement de la matière, en bref la
rhéologie. Son travail touchera l'industrie du bâtiment (le ciment), la
météorologie (les aérosols) ainsi que les secteurs touchant à la minéralogie et
la chimie alimentaire.
A côté
de la détermination de la dimension des molécules, les physiciens étaient
également préoccupés de savoir comment le mouvement se transmettait dans la
matière. Les physiciens savaient depuis longtemps, depuis qu'ils avaient observé
un morceau de bois flotté à la surface de l'eau, qu'une onde ne consistait pas
en un déplacement de la matière mais bien à un mouvement dans celle-ci.
|
On démontre ce principe quotidiennement par de nombreux mobiles, dont
celui des billes suspendues en contact les unes avec les autres. En
lançant la première bille sur la deuxième, quasi instantanément le choc se
propage à travers les autres billes provoquant le déplacement de la
dernière. Toutes les billes situées entre les deux extrémités restent
immobiles. La propagation se transmet de bille à bille, en d'autres termes
une certaine quantité d'énergie se propage dans la matière à une vitesse
finie. |
|
Le même
phénomène explique la propagation du son dans l'air. Ainsi, qu'elles soient
électromagnétiques ou élastiques, les ondes obéissent à une relation de
propagation appelée la fonction d'onde.
|
La
fonction d'onde
|
|
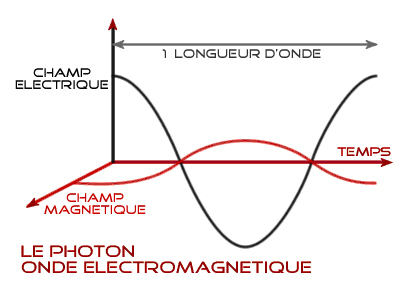
Une
onde qui se propage dans l'espace (x,y) et dans le temps (t) suit une
sinusoïde qui obéit à la relation :
y = a sin ( wt
+ f )
avec a,
son amplitude
w,
sa vitesse angulaire (2
)
f,
l'angle de phase
Son
intensité est égale au carré du module de son amplitude, soit |a|2.
Ainsi la lumière visible présente une fréquence
n ~
3x1015
cycles/sec ou 3x1014 Hz. |
|
 |
|
Onde :
champ électrique (E) et magnétique (B) qui oscillent ensembles. L’un
des champs pris
isolément ne peut créer cette structure particulière d’onde.
|
|
Au XIXe
siècle grâce aux travaux de Maxwell, les physiciens connaissaient son équation
généralisée aux différentielles partielles, sur laquelle nous nous
reviendront plus tard.
|
Une énergie quantifiée (II)
En 1900 Max Planck rédacteur en chef de l'édition allemande des Annales
de Physique découvre des contradictions en étudiant le rayonnement
d'un point de vue ondulatoire, sur base de la mécanique de Maxwell et des
travaux de Hertz. Nous savons tous que le fer chauffé à blanc rayonne dans
le visible entre 600 et 2000°C. Mais la théorie ondulatoire du rayonnement
qui prévalait depuis les démonstrations de Fresnel, Fizeau et Foucault ne
pouvait pas à la fois rendre compte des observations dans l’ultraviolet et
dans l’infrarouge. La formule ondulatoire impliquait que l'énergie du
rayonnement ultraviolet devait être infinie. |
 |
Tous
les savants savaient que le Soleil n’émettait pas une énergie de plus en plus
intense à mesure que la fréquence du rayonnement augmentait, tout comme un
tisonnier ne rayonnait pas de plus en plus fort à mesure que son éclat
augmentait; il existait un maximum au-delà duquel l’intensité du rayonnement
chutait. La formule fonctionnant pour toutes les fréquences plus basses, le
physicien viennois Paul Ehrenfest parla bientôt de "catastrophe ultraviolette".
Une autre formule développée par lord J.Rayleigh et James Jeans
expliqua bientôt le rayonnement ultraviolet mais ne s'appliquait plus aux basses
fréquences ! Quel lien y avait-il entre la fréquence et le niveau d'énergie ?
|
La loi
d'équipartition
La loi
exponentielle de Wien s'applique aux basses fréquences :
r
= an3e-bn/T
avec a,b
constantes
La loi
de Rayleigh s'applique aux hautes fréquences :
r(n,T)
= c1v2T
e-c2n/T
L'énergie d'équilibre U suit la relation :
U = kBT,
kB étant la constante de Boltzmann
La loi
d'équipartition ne peut expliquer de façon rigoureuse le lien qui existe
entre la fréquence et le niveau d'énergie. Il faudra attendre les
explications de Planck et d'Einstein basées sur la théorie quantique.
|
Les
signes avant-coureurs d'une erreur de formulation dans la loi d'équipartition
aux hautes fréquences arrivèrent dans les laboratoires de physique.. A Berlin, Planck essaya de trouver une formule hybride qui
réunirait les deux précédentes. Il finit par découvrir expérimentalement que
l'action (l'énergie) ne pouvait varier que par quantité finie en fonction de la
fréquence, obéissant à une constante de proportionnalité, h, égale à 6.625 x 10-34
Joule.sec
. La constante de Planck était née!
Planck
créa le concept du quantum d'action, produit d'une énergie par le temps, quantum
que G.Lewis baptisera "photon". Einstein compléta cette définition en découvrant
que l'énergie d'une onde de fréquence
n
est donnée par la formule E =
n .
Les quantités d'énergie devenaient discontinues !
.
Les quantités d'énergie devenaient discontinues !
L'introduction de quantités discrètes dans un phénomène jugé continu bouleversa
tout le monde de la physique et M.Planck lui-même, qui tenta un certain temps de
rejeter sa propre théorie. Bien que cette "constante de Planck",
 ,progresse par pas infime, on peut comprendre la révolution qu'elle allait
entraîner. 1 Joule représente l'énergie acquise par une masse de 1 kg tombant de
10 cm. Infiniment plus faible, 1 eV représente l’énergie acquise par un électron
au repos porté à la vitesse de 600 km/s. Insignifiante dans le monde qui nous
entoure, la constante de Planck apparaît dans toute sa réalité dans les
processus à l'échelle de "
,progresse par pas infime, on peut comprendre la révolution qu'elle allait
entraîner. 1 Joule représente l'énergie acquise par une masse de 1 kg tombant de
10 cm. Infiniment plus faible, 1 eV représente l’énergie acquise par un électron
au repos porté à la vitesse de 600 km/s. Insignifiante dans le monde qui nous
entoure, la constante de Planck apparaît dans toute sa réalité dans les
processus à l'échelle de " ",
c'est-à-dire dans toutes les interactions nucléaires. Le phénomène était si
contrariant qu'il fallut attendre 17 ans pour que M.Planck accède au prix Nobel
pour cette découverte fondamentale et ses travaux ultérieurs. Aujourd'hui,
l'aspect quantique du rayonnement est reconnu mais sa formulation reste encore
largement discutée.
",
c'est-à-dire dans toutes les interactions nucléaires. Le phénomène était si
contrariant qu'il fallut attendre 17 ans pour que M.Planck accède au prix Nobel
pour cette découverte fondamentale et ses travaux ultérieurs. Aujourd'hui,
l'aspect quantique du rayonnement est reconnu mais sa formulation reste encore
largement discutée.
Si le
quantum d'action est l'unité élémentaire d'énergie, la loi d'équivalence
d'Einstein implique qu'il existe également une masse minimale. En fait, cette
relation signifie en corollaire que la matière ne peut pas se décomposer à
l'infini, de la molécule à l'atome, de l'atome au quark et à je ne sais quelle
entité minimale. " "
signifie qu'il existe une énergie minimale, c'est-à-dire une masse limite, non
ponctuelle, en-dessous de laquelle il n'existe rien. Nous pouvons déjà donc
prédire que notre obstination réductionniste sera un jour interrompue dans sa
recherche de l'infini petit, probablement entravée à l'échelle des quarks, non
seulement par l'échelle de Planck mais aussi par le principe d'incertitude dont
nous reparlerons.
"
signifie qu'il existe une énergie minimale, c'est-à-dire une masse limite, non
ponctuelle, en-dessous de laquelle il n'existe rien. Nous pouvons déjà donc
prédire que notre obstination réductionniste sera un jour interrompue dans sa
recherche de l'infini petit, probablement entravée à l'échelle des quarks, non
seulement par l'échelle de Planck mais aussi par le principe d'incertitude dont
nous reparlerons.
Et si
la constante de Planck était nulle? Hé bien, le monde
quantique ne serait plus ce qu’il est. Les interactions entre systèmes
microscopiques obéiraient aux lois classiques de la mécanique newtonienne ou de
la relativité et l’atome de Bohr reprendrait du service. Il tournerait autour du
noyau puis… s’effondrerait !
Une
autre preuve de la réalité de l’existence de
 concerne l'effet photoélectrique. Alors que Planck venait de poser le concept du
quantum, le photon, et que bien peu de chercheurs le suivait dans cette démarche,
Einstein lui donna une réalité tout à fait physique en expliquant de quelle
façon les électrons véhiculaient l'énergie.
concerne l'effet photoélectrique. Alors que Planck venait de poser le concept du
quantum, le photon, et que bien peu de chercheurs le suivait dans cette démarche,
Einstein lui donna une réalité tout à fait physique en expliquant de quelle
façon les électrons véhiculaient l'énergie.
L'effet
photoélectrique fut découvert en 1887 par le physicien allemand Heinrich Hertz
qui découvrit qu'en illuminant deux surfaces métalliques sous tension au moyen
d'une lampe à arc il se produisit une étincelle électrique entre les plaques.
Deux ans plus tard, le hongrois Philippe Lénard et M.Wolf
confirment son observation grâce à des expériences sur le rayonnement
monochromatique et suggèrent que la lumière ultraviolette peut expulser des
grains de matière des surfaces métalliques. Il faudra attendre 1899 pour que
J.J.Thomson
comprenne que l'effet
photoélectrique induit par
la lumière ultraviolette était provoqué par l'émission d'électrons.
C'est
Lénard en 1902 qui trouva le début de l'explication : l'énergie des électrons
écrit-il "ne dépend d'aucune manière de l'intensité lumineuse".
Mais c'est Einstein
en 1905 qui trouva la bonne explication en se basant sur un principe heuristique,
en dégageant des règles à partir de ses recherches et de ses découvertes. Il
démontre que le quantum d'action représente une quantité d'énergie discontinue
qui peut être transmise aux électrons d'un métal. Puisque cette énergie est
constante à la source, la vitesse des électrons l'est aussi. Quelle que soit
l'intensité initiale des photons et la nature du matériau irradié,
l'amplification est linéaire; les électrons qui s'échappent de la surface
métallique se De l’usage de la constante de Planck propagent toujours avec la
même vitesse et la même énergie.
Einstein considère que la lumière se comporte comme un flux de particules qui
bombarde la surface métallique : plus la fréquence du rayonnement est élevée
plus l'énergie est importante.
Einstein fixe également plusieurs limites à l'effet photoélectrique :
- La
règle de Stokes : la fréquence du rayonnement photolumineux est toujours
inférieure à celle de la lumière incidente.
-
L'énergie de photo-ionisation d'un électron ne peut excéder l'énergie de la
lumière incidente,
 n.
n.
-
L'effet Volta et la limite de Duane-Hunt : un tube à rayons X fonctionnant à un
potentiel V possède une limite supérieure de fréquence qui obéit à la relation
eV =  n.
n.
La
théorie des quanta imaginée par Planck sera parfaitement appliquée par Einstein.
La découverte de l'effet photoélectrique conduira à de nombreuses appareils de
détection: le compteur à gaz, le compteur à scintillations,
les photomultiplicateurs d'images et les dosimètres thermoluminescents (DTL)....
|
La
formule de Planck |
|
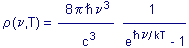
|
|
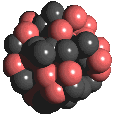
L'équation de la répartition du rayonnement du corps noir - de la
densité spectrale
r - en équilibre
thermique est uniquement fonction de la fréquence
n
et de la température T.
Elle est indépendante de la nature du corps.
 est la constante de Planck, k la constante de Boltzmann, c la vitesse
de la lumière. On retrouve la loi de Wien si
est la constante de Planck, k la constante de Boltzmann, c la vitesse
de la lumière. On retrouve la loi de Wien si
 n/kT
>> 1 . n/kT
>> 1 .
|
|
L'équation de l'énergie du rayonnement |
|
E =
 n
- P n
- P |
|
L'énergie E libérée par des électrons arrachés à une surface
métallique irradiée par une lumière de fréquence í explique l'effet
photoélectrique. |
|
L'équation des chaleurs spécifiques |
|
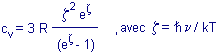 |
|
La
chaleur spécifique cv d'un atome-gramme d'un solide
cristallin ne dépend que du choix de la fréquence
n.
La fréquence est également appelée "température d'Einstein", TE
, lorsque z
= 1. R est la constante des gaz.
|
|
La
constante de Rydberg
|
|
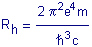 |
|
Lorsque
R est placée dans l'équation de Niels Bohr concernant la structure
atomique, on découvre que les électrons parcourent des orbites fermés
sans émettre d'énergie. On ne peut plus généraliser la loi
d'équipartition.
est placée dans l'équation de Niels Bohr concernant la structure
atomique, on découvre que les électrons parcourent des orbites fermés
sans émettre d'énergie. On ne peut plus généraliser la loi
d'équipartition.
|
|
La troisième apparition du quantum d'action concerne le problème de la chaleur
spécifique.
Depuis 1840, les chaleurs spécifiques du carbone, du bore et du silicium à
température ambiante étaient trop faibles. Ces corps solides ne satisfaisaient
pas à la relation entre chaleur spécifique et poids atomique. La chaleur
spécifique du diamant par exemple oscillait d'un facteur 3 entre 0 et 200°C et
d'un facteur 15 entre -100 et 1000°C ! Cette différence n'était pas accidentelle.
Cette anomalie était encore plus étrange pour les gaz.
En
novembre 1906 Einstein
publia un article sur les chaleurs spécifiques dans lequel il présenta le
premier graphique qualitatif basé sur les expériences de H.Weber sur le diamant.
Il expliqua que la chaleur spécifique æ était induite par un effet quantique qui
obéissait à la relation :
Lorsque
z
=1, la valeur de la température T est baptisée "température d'Einstein", TE,
et se manifeste pour TE
= 1300°K ce qui est en parfait accord avec la courbe
quantique de l'état solide du diamant.
Quelques années plus tard Einstein analysa les aspects dynamiques et
statistiques du problème. Il généralisa le calcul des chaleurs spécifiques tout
d'abord aux corps solides (1907) puis aux gaz (1913) C'est ainsi que l'on compris pourquoi des substances légères comme le diamant
présentaient des effets quantiques à température ordinaire.
C'est
en 1905 qu'Einstein pose la relation d'équivalence entre masse et énergie :
E = mc2
Cette
équation signifie que le champ d'énergie produit par une particule au repos est
égal à la masse de cette particule, au facteur c près. En suspend, cette
équation implique que la masse d'une particule qui se déplace à la vitesse de la
lumière se transforme en énergie, ou plus exactement, il faut considérer que
dans ses conditions sa masse n’est plus une inertie à vaincre mais plutôt une
énergie qui ne cesse d’augmenter .
La
loi de conservation de l'énergie (en Relativité)
Dans
d'autres conditions bien déterminées, cette particule émettra un rayonnement de
fréquence
n,
obéissant à la constante de Planck, tel que :
Ainsi
donc Einstein offrit à Planck une confirmation de la réalité du quantum d'action,
le photon et de la nature quantique de la lumière.
|
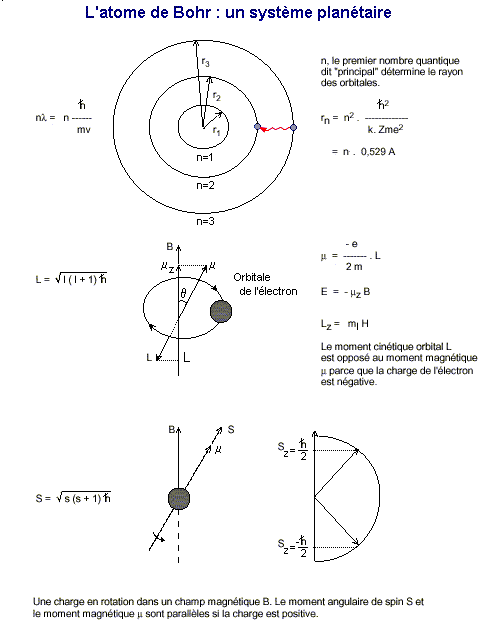
La conception atomique de Bohr (III)
En 1910, Rutherford tente de trouver une théorie qui expliquerait les
propriétés de l'atome. Il remarque en projetant un rayonnement á sur
différents matériaux que celui-ci est diffusé sous certains angles bien
définis et même renvoyé vers la source, comme s'il existait un point
matériel au centre de la matière sur lequel le rayonnement rebondissait.
Cette observation était tout à fait inattendue. Le modèle atomique de
Thomson précisait que les particules
a
devaient traverser le noyau et ne subiraient que de faibles déviations par
les charges positives. |
 |
Pour
expliquer cette collision élastique, en 1917 Rutherford propose une thèse
planétaire de l'atome qui s'articule autour des propriétés électriques de la
matière. Celle-ci est rassemblée dans un noyau de très petite dimension, environ
10-14 m de rayon, chargé d'électricité positive autour duquel gravite
dans un grand espace vide les électrons négatifs découverts par Thomson. En
appliquant les lois de l'électromagnétisme de Maxwell, cet atome (son électron)
devait rayonner sur toutes les fréquences, offrant un spectre continu.
Or,
quelques années plus tôt, en 1884 le suisse Johann Balmer
avait découvert des raies spectrales dans le spectre visible émis par l'atome
d'hydrogène (la série de Balmer). Il démontra que leur présence en des endroits
bien déterminés du spectre appliquait une sorte de loi universelle : la série de
raies de l'atome d'hydrogène s'obtenait en divisant la fréquence de chacune
d'elle par le carré d'un nombre premier, n, le premier des nombres dit "quantiques".
De façon générale, pour l'ensemble des raies, dont celles n'appartenant pas au
spectre visible cette relation empirique s'écrit
:
avec
l,
la longueur d'onde
RH,
la constante de Rydberg = 1.097x107 /m
Pratiquement, pour nf
= 2 et ni
= 3,
l
= 656 nm, c'est la fameuse longueur d'onde de l'hydrogène-alpha bien connue des
astronomes qui baigne de nombreuses nébuleuses
dans un halo rouge et permet également d'étudier l'activité de la chromosphère du
Soleil.
Le
modèle atomique de Rutherford traduit que tout atome contient le même nombre de
protons que d'électrons, c'est le numéro atomique du tableau de Mendéléev. Il
explique aussi les transitions atomiques qui provoquaient les raies spectrales.
Ainsi, un certain ordre naturel se retrouvait tant dans l'orbe des planètes que
dans la structure microscopique de l'atome. Cette relation n'est certainement
pas fortuite car elle conduisit à la formation de la matière et à l'agencement
de l'univers.
Mais en
1911 dans le laboratoire de Rutherford à Cavendish, le physicien danois Niels
Bohr fit remarquer que dans son mouvement circulaire l'électron devait s'épuiser
en émettant autant d'énergie et finirait inévitablement par tomber très
rapidement sur le noyau au bout d'une fraction de seconde (10-8
sec). D'un autre côté, le noyau et l'électron étant de
charges opposées, la force d'attraction électrique devait agir entre eux. Dès
lors, la moindre perturbation orbitale provoquerait l'annihilation de l'atome en
moins de 10-17
sec ! La théorie devait donc s'incliner devant les faits de
l'expérience.
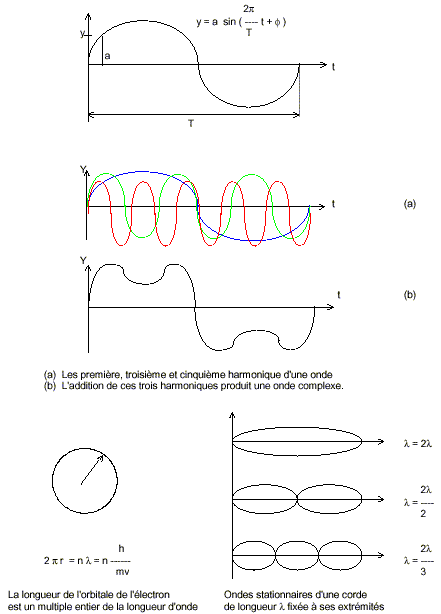
Si les
ondes stationnaires sont des multiples et des sous-multiples de la longueur
d'onde, cela revient à dire que la longueur d'onde de l'orbitale de l'électron
(2pr)
est un multiple entier de celle-ci. Exprimé en termes cinétiques et quantiques
la formule précédente s'écrit :
Dès
lors la circonférence de l'orbitale de l'électron vaut (nl)
ou exprimée sous forme cinétique:
Bohr
reprit le concept d’Einstein consistant à dire que le rayonnement transportait
des quanta d’énergie. Il reconnaissait ainsi la validité de la constante de
Planck et des observations de Balmer. C’est ainsi que Bohr se demanda en 1913 si
les raies du spectre ne pouvaient pas s'exprimer selon des proportions simples
Dans
son état fondamental l'atome n'émet pas de photon. Mais dès qu'il change
d'orbitale, il absorbe ou émet une énergie proportionnelle à
 .
Jusqu'ici la formule inventée par John Nicholson sera appliquée avec
clairvoyance par Bohr. On y retrouve l'intégrale qui définit le mouvement des
particules comme étant égale à la constante de Planck multipliée par un nombre
quantique. Puisque
.
Jusqu'ici la formule inventée par John Nicholson sera appliquée avec
clairvoyance par Bohr. On y retrouve l'intégrale qui définit le mouvement des
particules comme étant égale à la constante de Planck multipliée par un nombre
quantique. Puisque
 n
=
n
=  c/l,
on retrouve également le résultat empirique de Balmer. Cette formule de
Nicholson-Bohr conduira à l'équation finale de Dirac.
c/l,
on retrouve également le résultat empirique de Balmer. Cette formule de
Nicholson-Bohr conduira à l'équation finale de Dirac.
Représentation d'une Onde:
(Notons aussi que la "porteuse" d'onde est toujours égale
à c, soit la célérité de la lumière: 300 000 000 m/s.
Il ne fait pas la confondre avec les différentes
harmoniques dues aux absorptions et émissions électroniques fonctions des
oscillations des électrons sur ses couches superficielles.)
Bohr
supposa également que chaque raie correspondait à un saut de l'électron en
fonction de son énergie. Il postule que les électrons ne peuvent graviter que
sur certaines orbitales, en provoquant des émissions discrètes d'énergie. Pour
empêcher l'électron de s'écraser sur le noyau, il impose une orbite
fondamentale r n , en-dessous de laquelle l'électron ne peut pas tomber.
Cette formule est déduite des relations précédentes et de la seconde loi de
Newton (F =
ma) où "F" représente la
force électrique (kZe²/r²). Cette loi permet d'aboutir à une relation cinétique
qui exprime le rayon de l'orbitale de l'électron en fonction du nombre quantique
principal, n. Dans cette équation le quantum d'action
 =
=
 /2p,
mais il est plus commode de le représenter par la constante de Planck, Z étant
le nombre de protons. Ce "rayon de Bohr" est égal à :
/2p,
mais il est plus commode de le représenter par la constante de Planck, Z étant
le nombre de protons. Ce "rayon de Bohr" est égal à :
Le
résultat de Bohr permet du même coup de connaître l'énergie minimale que
l'électron pouvait avoir. Dans son état fondamental son énergie Eo
vaut :
Bohr
conserve la loi de la conservation de l'énergie d'Einstein en stipulant que
l'énergie gagnée ou perdue (Ei,
Ef)
par un électron lorsqu'il change d'orbitale se transforme en une absorption ou
une émission d'un photon d'une fréquence
n
déterminée, telle que :
 ni,f
= Ei - Ef
ni,f
= Ei - Ef
Mais en
1896 le physicien hollandais Pieter Zeeman découvrit que chaque raie pouvait
être composée de plusieurs raies plus fines appelées doublets et triplets,
observation confirmée plus tard par Johannes Stark (1913) et Karl Schwarzschild
(1916). Cette "structure fine" comme elle sera baptisée n'était pas décrite dans
le modèle original de Bohr. De plus celui-ci ne permettait pas à l'électron de
graviter sur des trajectoires non circulaires, limitant ses degrés de liberté à
une seule variable, n. Cette théorie n'était donc pas complète.
En 1915
Arnold Sommerfeld introduit un second nombre quantique l, dit nombre
quantique secondaire, pour permettre à l'électron de graviter sur des orbitales
elliptiques. Il découvrit également une formule relativiste qui confirmait la
structure fine de l'atome. Mais cette théorie, tout comme celle de Bohr ne
tenait pas compte de l'intensité des raies. La formule de Bohr indiquait un trop
grand nombre de raies par rapport aux analyses de spectroscopie. Il fallait
trouver une méthode pour réduire l'intensité de certaines d'entre elles à zéro.
Bohr
fit une analyse astucieuse des raies d'émission de l'atome en exploitant les
sauts d'énergie quantiques. Il mélangea les théories de Newton (l'orbite de
l'électron) et les lois quantiques de Planck ("sauts" d'orbites). Le mouvement
de l'électron engendrant un champ magnétique, il introduisit un nombre quantique
magnétique m, appelé magnéton. Les séries de raies n'obéissant plus tout à fait
à sa loi, Bohr établit une correspondance entre les fréquences observées et
celles déterminées par son calcul quantique. En 1918 sa théorie planétaire de
l'atome doit s'adjoindre un "principe de correspondance", que d'aucun considère
comme trop artificiel, Werner Heisenberg en particulier. Les physiciens
reprochaient à Bohr de chercher à tout prix à maintenir sa théorie. Son principe
de correspondance était trop imprécis et certaines raies imposaient le produit
de trois nombres quantiques successifs (n, l, m) qu'il ne pouvait plus
expliquer.
S.Goudsmit et G.Uhlenbeck reprirent alors la conception planétaire de la
structure de l'atome. L'effet Zeeman résultant en première approximation des
mouvements orbitaux des électrons, le mouvement d'un atome devait
obligatoirement être lié à sa charge électrique et à sa masse. Or la
spectroscopie indiquait l'existence d'effets Zeeman anormaux, que ni la théorie
classique ni la théorie quantique ne pouvaient expliquer. Théoriquement
cependant, Einstein et Barnett
avaient déjà démontré quelle devait être la grandeur du rapport entre le moment
magnétique et le moment cinétique
de l'électron. On savait également depuis les travaux de Faraday et de Maxwell
que la magnétisation d'un barreau de fer entraînait sa mise en rotation et
inversement, c'est le gyromagnétisme. Les effets Zeeman anormaux étaient
justement considérés comme des anomalies "gyromagnétiques".
En 1925
Goudsmit et Uhlenbeck émettent l'idée que l'électron dispose d'un magnétisme propre et est animé d'un
mouvement de rotation sur lui-même. Ils proposent que l'électron, comme une
planète sur son axe, peut tourner dans un sens ou dans un autre, mouvement
qu'ils dénommèrent le spin. Sa grandeur était égale aux prédictions : le
moment cinétique de l'électron était égal à 1/2
 .
Son action pouvait induire certaines raies spectrales non expliquées par la
théorie planétaire de Bohr. Le nombre de spin sera le quatrième nombre quantique,
s, valant +1/2 ou -1/2 selon les cas (seuls les bosons ont un nombre de
spin égal à une valeur entière de
.
Son action pouvait induire certaines raies spectrales non expliquées par la
théorie planétaire de Bohr. Le nombre de spin sera le quatrième nombre quantique,
s, valant +1/2 ou -1/2 selon les cas (seuls les bosons ont un nombre de
spin égal à une valeur entière de
 )
.
)
.
Mais la
théorie de Bohr éluda totalement les propriétés ondulatoires de la lumière. Les
phénomènes d'interférences de phases et d'amplitudes s'accordaient mal avec le
concept de corpuscule, sans oublier que l'explication de la structure fine
restait incomplète.
|
La structure
électronique de l'atome (IV)
Armé de tout cet arsenal théorique, comment peut-on représenter un atome ?
Prenons l'atome d'hydrogène pour exemple, composé d'un seul proton et d'un
seul électron. Au repos, son unique électron orbite à une distance bien
précise, un des quatre nombres "quantiques" obéissant à la constante de
Planck et à la théorie de Bohr. Ce nombre quantique principal est
représenté par la lettre n et défini à lui seul tous les états
d'énergie de l'atome : |
 |
Le
niveau fondamental de l’électron (où n = 1) est fixé à 0.53 Å du noyau. Il est
prouvé mathématiquement par cette fameuse équation de Schrödinger, une équation
aux différentielles triples, la première que les étudiants apprennent à
démontrer au cours de chimie supérieur.
Mais
plutôt que d’orbitale, nous devrions parler de couche fondamentale ou de nuage
électronique occupé par l’électron. Les lois de la physique quantique stipulent
que ce nuage est sphérique et centré sur le noyau. C'est la couche k
également appelée état 1s. Si un seul nombre quantique suffit à
déterminer l'énergie et le moment cinétique de chaque état d'un atome, la
résolution de l'équation de Schrödinger permet de démontrer que le moment
cinétique L est lié à un second nombre quantique indépendant, le nombre
quantique orbital l par la formule :
L = √ [
l
(l
+ 1)
 ] avec
l = 0,1,2,3... n-1
] avec
l = 0,1,2,3... n-1
où " "
représente la constante de Planck. Puisque la valeur absolue du carré de la
fonction d'onde |Y|2
mesure la probabilité de localiser l'électron en un point "r" de l'espace, pour
n = 1 et l = 0, les fonctions d'ondes associées à ces états
électroniques présentent une symétrie centrale, l'électron ayant toutes les
chances de se trouver dans le noyau (r = 0).
"
représente la constante de Planck. Puisque la valeur absolue du carré de la
fonction d'onde |Y|2
mesure la probabilité de localiser l'électron en un point "r" de l'espace, pour
n = 1 et l = 0, les fonctions d'ondes associées à ces états
électroniques présentent une symétrie centrale, l'électron ayant toutes les
chances de se trouver dans le noyau (r = 0).
Au
premier état d'excitation, grâce à un apport d'énergie de 13.6 eV
, l'électron passe sur la seconde couche permise l, située à 2.12 Å du
noyau (22
x 0.53). Le nuage électronique s'étend et prend l'aspect non plus d'une sphère
mais de deux lobes qui ne sont plus connectés radialement à l'état fondamental,
c'est l'état 2p. Cette seconde couche, comme toutes les suivantes sont
divisées en sous-couches (s, p, d, f, etc), déterminées par le nombre quantique
orbital.
Lorsque
l'atome est soumis à champ électromagnétique intense, la direction du moment
cinétique ne présente pas une distribution continue contrairement à ce que
laisse présumer le concept d'énergie. L’analyse de Fourier de l'équation de
Schrödinger a démontré que l'énergie des photons n’était émise ou absorbée qu'à
certains niveaux d'excitation des électrons. Ainsi pour une valeur précise de
l , le nombre quantique magnétique m ne peut prendre que certaines
valeurs : - l, - l + 1,..., 0,..., l -1, l. Chaque sous-couche est donc divisée
en cases quantiques définies par le nombre quantique magnétique, m qui
lui donne son orientation dans l'espace.
Mais
même en l'absence de champ magnétique, la plupart des raies spectrales ont une
structure fine formée de doublets très étroits. L'électron n'est donc pas
entièrement déterminé par ces trois nombres quantiques n, l et m.
Un quatrième nombre quantique vient s'ajouter pour déterminer le moment
cinétique propre de l'électron, c'est le moment angulaire de spin S où s
est le nombre quantique de spin :
S = √
[ s (s + 1)
 ]
]
Le
nombre quantique magnétique et le nombre de spin sont en corrélations et ne
peuvent prendre que deux orientations, l'une par rapport à l'autre suivant la
grandeur du moment angulaire S sur l'axe vertical. Si deux électrons sont sur la
même couche, ils auront un nombre de spin opposé (s = 1/2 ou -1/2), en rappelant
le principe d'exclusion de Pauli interdisant à deux électrons d'avoir les quatre
nombres quantiques égaux deux à deux. Si c'était le cas les particules
pourraient occuper n'importe quel état quantique et seraient indiscernables les
unes des autres, non identifiables à un instant donné. Pratiquement cela conduit
à rendre les couches les plus basses (k, l, m, ...) rapidement saturées avec
respectivement 2, 8 et 18 électrons, et ainsi de suite. Si le nombre de spin est
nul, cela signifie que la particule ne tourne pas, comme c’est le cas pour les
mésons.
Si
l'atome subit un excitation très forte, au deuxième état d'excitation l'électron
passera sur la troisième couche possible à 4.47 Å (32 x 0.53), etc.
Les couches se complexifient à mesure que l'énergie augmente et sont infinies,
délimitées par un "nuage d'indétermination" où l'on peut trouver l'électron.
Mais il existe une probabilité non nulle de trouver l'électron en dehors de la
matière suite à l'effet tunnel. Cette distance est toutefois limitée car cette
probabilité décroît rapidement à mesure que l'on s'éloigne de la matière. Au-delà
de quelques nanomètres l'atome ne peut plus retenir l'électron par sa force
électrostatique (coulombienne) et l'atome s'ionise. En
pratique quelques eV suffisent pour ioniser un atome.
Les
états excités des atomes sont transitoires. Le premier état d'excitation
persiste 10-8
sec. L'électron tente alors de retomber à un état de moindre énergie, plus
stable. Si l'atome est dans un état naturel excité au niveau 2, il "redescendra"
au niveau 2. Ce retour à l'état plus stable s'accompagne d'une libération
d'énergie (bremsstrahlung), d'une fréquence tributaire de l'étage d'excitation
duquel "chute" l'électron et du degré d'ionisation des atomes. Ce peut-être une
radiation du spectre visible, un rayonnement
a
ou X dans le cas d'une réaction nucléaire ou une radiation monochromatique laser
(optique) ou maser (radio) lorsqu'il s'agit de réactions atomiques. La durée du
phénomène est fonction de la quantité de matière et des niveaux de transitions
atomiques.
Le
rayonnement, induit dans le cas présent par les électrons, peut aussi apparaître
suite à une transition électronique entre deux sous-niveaux. La raie de
l'hydrogène à 21 cm par exemple (atome HI) correspond au changement de rotation
du proton (spin) suite à l'interaction avec le spin de l'électron. Cette
énergie ainsi libérée est inversement proportionnelle à la longueur d'onde, en
parfait accord avec la distribution des énergies de la formule de Planck. A de
très courtes longueurs d'ondes, la densité du rayonnement du corps noir devient
très faible mais les photons présentent un niveau d'énergie très élevé. Seule la
théorie quantique permet une telle affirmation qui ne peut être démontrée par
une théorie ondulatoire. Dans le cas de la lumière du Soleil, l'excitation est
tellement intense que tous les atomes sont le siège de transitions très variées,
donnant à sa lumière une coloration dite blanche, polychromatique. Son spectre
est continu (des raies d'absorption s'y superposent pour chaque élément présent
dans son atmosphère). Cette théorie quantique est confirmée expérimentalement
dans les accélérateurs de particules, les mesures radioastronomiques et la
spectroscopie et s'applique donc à la totalité du spectre électromagnétique.
La
spectroscopie
Entre-temps,
rappelons que du 30 octobre au 3 novembre 1911, le 1er Congrès Solvay fut organisé à Bruxelles, portant sur "la théorie du rayonnement et des quantas".
Toute l'élite de la science était présente et discuta pendant 4 jours de l'essor
de la nouvelle physique quantique. Einstein y fit une entrée timide mais il
était entouré des non moins célèbres Max Planck tout auréolé de la découverte
des quantas, Marie Curie, Maurice de Broglie, Paul Langevin, Jean Perrin, Henri
Poincaré, Ernest Rutherford, Wilhem Wien,... un parterre de 24 savants membres
du nouveau noyau dur de la physique. On y parla du corps noir et des quantas,
des atomes, des principes de la thermodynamique, du chaos, de relativité, autant
de concepts considérés avec méfiance par l'ancienne génération de savants.
|
La mécanique ondulatoire (I)
Face à la théorie de Heisenberg, un nouveau concept était en train de
naître. En 1924, le physicien français Louis de Broglie imagina que les
atomes pouvaient se comporter comme des ondes. Louis de Broglie fit une
synthèse géniale des lois quantiques et relativistes qui lui vaudra le
prix Nobel.
Les fréquences "quantiques" qui s'accordaient parfaitement avec la formule
de Nicholson-Bohr et la constante de Planck, n'obéissaient plus tout à
fait à la théorie classique de Bohr. |

|
Il
fallait donc modifier la théorie et étant donné que personne n'avait jamais
observé un électron sur son orbitale, Louis de Broglie se demanda pourquoi ne
pas en arriver à une modification radicale du concept atomique... Il était un
fait que ce que nous savions de certains atomes était uniquement lié aux raies
spectrales et à leur intensité...
Ayant
parfaitement maîtrisé les travaux d'Einstein, Louis de Broglie considéra que la
lumière, avec ses propriétés ondulatoires était constituée de photons (et leur
attribua avec erreur une masse). Sachant qu'il existait une relation entre
l'énergie des particules et la fréquence de leurs rayonnements, de Broglie
inventa la “mécanique ondulatoire”, faisant l’hypothèse qu’à toute particule de
masse m et de vitesse
v était associée une
onde de longueur d’onde
l
et de fréquence n
:
Son
hypothèse sera suivie par Léon Brillouin et Harry Bateman.
Si la représentation ondulatoire imaginée par de Broglie était correcte, il
était mathématiquement possible de créer les “harmoniques", les vibrations
multiples qui expliqueraient par exemple les raies de la série de Balmer émises
par l'hydrogène.
Dans le
cadre d'une théorie ondulatoire cette idée semblait
idiote. A première vue,
une onde discontinue est un non-sens car sa réalité n'est pas formée d'unités
distinctes, sa grandeur ne variant pas par quantités entières, mais de façon
continue. Plusieurs exemples confirment néanmoins cette idée de "fonction d'onde".
Imaginons que nous représentons la trajectoire d'un électron par une corde de
violon en vibration. L'analyse de Fourier démontre que les ondes harmoniques
produites par cette corde en vibration ne sont formées que d'un nombre entier
d'ondes fondamentales. En attachant cette corde à l'une de ses extrémités, le
fait de la secouer provoque le déplacement d'une onde bien connue. Si vous
attachez ses deux extrémités, comme la corde du violon, l'onde qui
habituellement se propage se stabilise, produisant ce que l'on appelle une
onde stationnaire qui
ne peut vibrer qu'entre ses attaches, que l'on dénomme des noeuds.
Cette corde fermée représente les sarabandes sans fins de la trajectoire de
l'électron autour du noyau. En réalité, comme l'électron, l'onde se propage bien
mais est réfléchie lorsqu'elle arrive sur un noeud.
L'électron quant à lui continue ses sarabandes sans reconnaître le début de la
fin de sa trajectoire. La réflexion de l'onde sur un noeud annule certains
phases, forçant la corde à passer par un minimum et un maximum, rendant
invisible l'onde de propagation habituelle. En d'autres termes, l'onde se
propage par fraction entière :
ln
= 2l/n.
On peut
également démontrer ce phénomène de résonances avec un tuyau d'orgue. Dans le
mode dit "fondamental" la longueur d'onde du son vaut quatre fois la longueur du
tuyau. Son amplitude est maximale à l'extrémité ouverte. La longueur d'onde peut
donc varier de façon non continue, interdisant certaines grandeurs. Nous
retrouvons ce phénomène dans le spectre de l'hydrogène qui affiche les raies de
la série de Balmer à certains endroits et nul part ailleurs.
|
L'interprétation
probabiliste (II)
Grâce aux lois de la mécanique classique, nous savons que la trajectoire
d'une particule peut être parfaitement déterminée par trois paramètres, sa
position (q),
sa masse (m) et
sa vitesse (v),
le produit de ces deux dernières quantités représentant la quantité de
mouvement ou impulsion (p).
Lorsque Schrödinger remplaça les particules par des ondes pour expliquer
le spectre des atomes, son équation souleva quelques difficultés. |
|
La
première d’entre elles était que son équation était en contradiction avec la
mécanique quantique. S'il y avait deux électrons, il y avait deux équations et
12 dimensions, ce qui ne reflétait aucune réalité. Nous avons vu comment Born
résolu ce problème. En fait disait-il, la fonction d'onde de Schrödinger décrit
la probabilité
d'observer un électron ou une autre particule à un endroit. Les scientifiques se
rendirent alors compte que cette fonction d'onde
Y
décrivait quelque chose de bien plus subtil; les trajectoires devenaient des
nuages probabilistes.
Ainsi
que l’apprenne aujourd’hui tous les étudiants, cela signifie concrètement que
notre chance de localiser une particule n’est jamais égale à 100% dans le monde
quantique. Nous pouvons avoir 3 chances sur 4 de trouver l'électron là où nous
l'avons calculé mais nous ne pouvons pas en être certain. Comme le rappela
Heisenberg,
"la fonction d'onde représente précisément le possible et non
pas le réel ". Seule certitude, en moyenne, sur
base d'un calcul statistique trois fois sur quatre l'électron se trouvera bien
au rendez-vous des sommets des amplitudes maximales (des crêtes). Cela nous
permet de calculer le niveau d'énergie des atomes pour déterminer leurs
propriétés, la longueur d'onde des raies qu'ils émettront par exemple.
Deuxième difficulté, le problème de la localisation d'une particule, encore
relativement simple à résoudre si l'on travaille avec quelques particules, se
complexifie dans un milieu gazeux qui contient des milliards de particules,
chacune étant dans une orientation et un état de vibration particuliers. Les
dimensions du système tendent vers l'infini
tout comme la structure mathématique de l’espace vectoriel correspondant. Les
physiciens doivent travailler par approximation, encore faut-il connaître cette
formule approximative, ou user d'une méthode statistique pour déterminer la
position, la vitesse et la masse d'une particule isolée.
Les
physiciens comprirent que s’ils désiraient évaluer la probabilité qu'une
particule se comporte d'une manière ou d'une autre, ils devaient répéter
l’événement un nombre suffisant de fois. En faisant évoluer rapidement les
fonctions d'ondes, la probabilité tend à faire disparaître tous les états
possibles, sauf un, celui dans lequel se trouve la particule.
En ce
qui concerne l'électron, on parle de nuage orbital, d'orbites probabilistes
plutôt que d'une trajectoire qui obéissent à l'équation de Schrödinger. A partir
de l'instant où la position de la particule est localisée, la probabilité est
levée, et comme le dit Heisenberg il a “effondrement” ou "réduction du paquet
d'ondes". La grandeur n'a donc de réalité en mécanique quantique que si
l'événement peut-être vérifié par de nombreuses mesures.
En
septembre 1926, Bohr invita Schrödinger à Copenhague mais tous deux restèrent
inflexibles sur l'interprétation de la nouvelle théorie. Aux yeux de Bohr, la
théorie ondulatoire, de caractère continu était incompatible avec le phénomène
discontinu que représentaient les "sauts quantiques". Pour Schrödinger
l'interprétation probabiliste était irréaliste. Dans son esprit, l'atome devait
être conçu comme un tout, une "vibration universelle" car sa fonction d'onde
contenait toutes les informations de la particule. Il croyait à la philosophie hindou : "tout
est dans tout". En fait Bohr et Schrödinger n'interprétaient pas les résultats
expérimentaux de la même façon. Il faudra attendre une année pour réconcilier
les deux physiciens. Dans une certaine mesure cette controverse subsiste encore
aujourd'hui.
L’antimatière (III)
Poursuivant ses recherches, Schrödinger découvrit une formule qui s'adaptait aux
particules se propageant à faible vitesse, formule quantique qui portera son
nom, mais qui ne tenait pas compte de la théorie de la relativité. La fonction
d'onde se caractérise par deux variables : sa position
r au temps t. La
fonction d'onde n'est valable que si l'énergie totale
E de cette particule se définit
par sa quantité de mouvement p
(sa vitesse multiplié par sa masse), dans les limites ou le
rapport v/c est très petit, selon l'approximation:
qui
s'écrit aussi :
La
relation de Louis de Broglie peut alors subir une deuxième lecture. Une
particule peut être décrite en fonction de son énergie et de son impulsion. Ces
quantités étant reprises au dénominateur, il s'ensuit que si l'on veut sonder
les soubassements de la matière, à mesure que la distance s'amenuise les
quantités d'énergie et d'impulsion à mettre en jeu seront de plus en plus
importantes, d'où la construction d'accélérateurs de particules toujours plus
puissants.
En 1930
le physicien anglais Paul Dirac proposera une équation relativiste équivalente (théorie
de l'électrodynamique quantique, EDQ) qu'il déduira de la formule quantique de
Nicholson-Bohr et de l'équation d'équivalence d'Einstein, E = mc2.
Si la vitesse de la particule est élevée, l'approximation précédente devient :
E2 = m2c4
+ p2c2
Si v = 0, E =
±
√m2
Mais
l'équation de Dirac cache une subtilité. Si la masse de la particule est
négative, l'équation est tout de même vérifiée. Cela signifie qu'une particule
peut présenter un état d'énergie négatif.
Le
passage de l'état excité au niveau fondamental laisse apparaître une transition
d'énergie valant 2m, un saut de +m à -m. Cette discontinuité est absurde en
physique classique. Mais rétorque sa variante quantique, ce comportement est
tout à fait normal ! Dirac considéra que rien n'empêchait une particule de
sauter cette barrière d'énergie pour se retrouver dans un état négatif. Mais si
le phénomène existait, pourquoi toutes les particules - et en particulier les
électrons - ne tombaient-ils pas vers les énergies les plus basses qui tendent
vers moins l'infini ?
Pour
expliquer ce phénomène, Dirac conclu que les états d'énergie négatifs étaient
tous saturés de particules virtuelles.
Si ces particules virtuelles recevaient une énergie 2m (en émettant des
photons), elles basculeraient dans la réalité en laissant un "trou" négatif dans
le monde virtuel. Ce déséquilibre serait considéré comme un surplus d'énergie
positive. Dirac cru d'abord qu'il s'agissait du proton, seule particule positive
connue à l'époque, mais elle devait avoir la même masse que l'électron. Cette
charge positive nouvellement crée sera appelée
positron ou
antiélectron. Ainsi naquit l'antimatière
à la plus grande joie des auteurs de science-fiction.
Bien
que très déroutante, sa théorie sera confirmée au Caltech en décembre 1932 par
les physiciens Carl Anderson et Patrick Blackett qui détectèrent le positron
dans les rayons cosmiques. Depuis, la quasi totalité des particules ont trouvé
leur opposé y compris les particules neutres..
Principe d’exclusion et statistique de Fermi-Dirac
Après
cette découverte Wolfgang Paulise pencha sur les propriétés de la matière ou du rayonnement. La question était
de savoir pourquoi la lumière pouvait se mélanger à un autre faisceau lumineux
ou vibrer en cohérence alors qu’il était impossible de fusionner deux blocs de
matière.
En 1935
Pauli énonça le "principe d'exclusion". Pour empêcher expliqua-t-il, deux
fermions (toutes les particules sauf les bosons) d'occuper le même état
d'énergie, ceux-ci ne peuvent avoir la même combinaison des quatre nombres
quantiques pris 2 à 2, qu'il s'agisse du niveau d'énergie, du spin, du moment
angulaire, etc. Si cela pouvait se produire, les électrons des différentes
couches "chuteraient" sur le noyau et deviendraient indiscernables; c'est la
statistique de Fermi-Dirac. C’est l’action de ce principe et la structure du
noyau qui donne sa consistance à la matière.
A suivre!
Retour à la table des matières de
physique